El
• En la filosofía de la antigua
Grecia, la palabra “átomo” se empleaba para referirse a la parte de materia más
pequeño que podía concebirse.
•
Átomo significa en griego “no
divisible”.
•
En el siglo V antes de
Cristo, el filósofo griego Demócrito postuló, sin evidencia científica, que el
Universo estaba compuesto por partículas muy pequeñas e indivisibles, que llamó
"átomos".
• A esta especulación se le
llamó Atomismo, la cual hablaba de la existencia de átomos indestructibles e
indivisibles.
• Con los avances científicos y
la aparición de la ciencia experimental se ha demostrado que la estructura
atómica integra a partículas más pequeñas
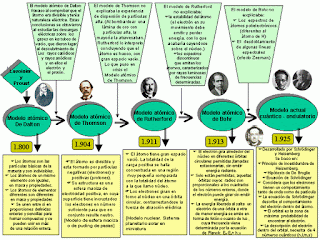
El Modelo de DALTON (1808):
John Dalton (1766-1844) fue un químico y físico británico que
creó una importante teoría atómica de la materia basada en las leyes de la
combinación química. Considerado el padre de la teoría atómica –
molecular. Para Dalton los átomos eran esferas
rígidas. Su teoría se puede resumir así:
• Los elementos químicos están formados por partículas muy
pequeñas e indivisibles llamadas átomos.
• Todos los átomos de un elemento químico dado son idénticos en su
masa y demás propiedades.
• Los átomos de diferentes elementos químicos son distintos, en
particular sus masas son diferentes.
• Los átomos son indestructibles y retienen su identidad en los
cambios químicos.
• Los compuestos se forman cuando átomos de diferentes elementos
se combinan entre sí, en una relación de números enteros sencilla, formando
entidades definidas (hoy llamadas moléculas).
El Modelo de THOMSON (1898):
Sir Joseph John Thomson (1856 -1940), fue un físico británico
que descubrió la existencia del ELECTRÓN, partícula subatómica cargada
negativamente. Según el modelo de Thomson, conocido como "modelo del
pastel de pasas", el átomo consistía en una esfera uniforme de materia
cargada positivamente en la que se hallaban incrustados los electrones de un
modo parecido a como lo están las semillas en una sandía (patilla). Este
sencillo modelo explicaba el hecho de que la materia fuese eléctricamente
neutra, pues en los átomos de Thomson la carga positiva era neutralizada por la
negativa.
Para explicar la formación de iones, positivos y negativos, y la
presencia de los electrones dentro de la estructura atómica, Thomson ideó un
átomo parecido a un pastel de frutas: una nube positiva que contenía las
pequeñas partículas negativas (los electrones) suspendidos en ella
El Modelo de Rutherford (1911):
El Modelo de Rutherford (1911):
Sir Ernest Rutherford (1871 - 1937), famoso hombre de ciencia
inglés que obtuvo el premio Nobel de Química en 1919, fue un físico neozelandés
que identificó en 1898 dos tipos de las radiaciones emitidas por el Uranio, a
las que llamó alfa y beta.
El hecho de que sólo unas pocas radiaciones sufriesen
desviaciones hizo suponer que las cargas positivas que las desviaban estaban
concentradas dentro de los átomos ocupando un espacio muy pequeño en
comparación a todo el tamaño atómico; esta parte del átomo con electricidad
positiva fue llamado NÚCLEO.
En el modelo de Rutherford, los electrones se movían
alrededor del núcleo como los planetas alrededor del Sol. La carga
eléctrica del núcleo y de los electrones se neutralizan entre sí, provocando
que el átomo sea eléctricamente neutro. Los electrones no caían en el núcleo,
ya que la fuerza de atracción electrostática era contrarrestada por la
tendencia del electrón a continuar moviéndose en línea recta. Este modelo fue
satisfactorio hasta que se observó que estaba en contradicción con una
información ya conocida en aquel momento: de acuerdo con las leyes del
electromagnetismo, un electrón o todo objeto eléctricamente cargado que es
acelerado o cuya dirección lineal es modificada, emite o absorbe radiación
electromagnética.
El Modelo de Bohr (1913):
Después de los descubrimientos de Rutherford, los científicos
pensaron en el átomo como un sistema solar microscópico, con los electrones
girando en órbita alrededor del núcleo, Bohr al principio supuso que los
electrones se movían en órbitas circulares, pero la física clásica decía que
una partícula con carga eléctrica debía perder energía, lo que llevaría en un
momento hacer al electrón caer hacia el núcleo, entonces Bohr dijo que las
leyes conocidas de la física eran inadecuadas para describir algunos procesos
de los átomos. El físico Danés Niels
Bohr, premio Nobel de Física en 1922, introdujo en 1913 los tres postulados
siguientes:
Primer Postulado: El producto del
impulso o cantidad de movimiento (mv) del electrón por la longitud de la
órbita que describe es un múltiplo del cuanto de energía (primer postulado).
Segundo Postulado: Mientras un
electrón gira en una orbita fija no emite energía radiante.
Tercer Postulado: Un electrón
puede saltar desde una orbita de energía a otra inferior de menor energía. En
este salto el átomo emite una cantidad de energía radiante igual a la
diferencia de energía de los estados inicial y final.
Aunque la teoría de Bohr fue de gran utilidad, tenía fallas,
para empezar años después el electrón se identificó con un comportamiento de
onda y en este modelo eso no se tomó en cuenta, además el modelo solo
funcionaba para el hidrógeno, dejando fuera las relaciones electrón - electrón
en átomos de muchos electrones.
Modelo Cuántico:
El físico E. Schrödinger estableció el modelo mecano-cuántico
del átomo, ya que el modelo de Bohr suponía que los electrones se encontraban
en órbitas concretas a distancias definidas del núcleo; mientras que, el nuevo
modelo establece que los electrones se encuentran alrededor del núcleo ocupando
posiciones más o menos probables, pero su posición no se puede predecir con
exactitud.
Con estas dos partículas, se intentó construir todos los átomos
conocidos, pero no pudo ser así porque faltaban unas de las partículas
elementales del núcleo que fue descubierto por J. Chadwick en 1932 y que se
llamó neutrón. Esta partícula era de carga nula y su masa es ligerísimamente
superior a la del protón (1,6748210-27kg.). Sin negar el considerable avance
que supuso la teoría atómica de Bohr, ésta solo podía aplicarse a átomos muy
sencillos, y aunque dedujo el valor de algunas constantes, que prácticamente
coincidían con los valores experimentales sencillos, el modelo no fue capaz de
explicar los numerosos saltos electrónicos, responsables de las líneas que
aparecen en los espectros de los átomos que poseen más de un electrón. Al
modelo de Bohr se le fueron introduciendo mejoras, pero la idea de un átomo
compuesto por orbitas alrededor de un núcleo central puede considerarse
demasiado sencilla, no fue posible interpretar satisfactoriamente el espectro
de otros átomos con más de un electrón (átomos poli electrónicos) ni mucho
menos la capacidad de los átomos para formar enlaces químicos.
Estructura del atomo
1 elemento se cambia con otro el
primero gano los electrones el otro lo pierde hablamos de iones
ion positivo cede electrones
Masa
atómica:
La masa atómica es la cantidad de materia que tiene un átomo y
generalmente se obtiene de sumar
Z el numero de protones mas el numero de neutrones N da igual a la masa atomica A
El número atómico:
El
número atómico es el número entero positivo que equivale al número total de
protones en un núcleo del átomo. Se suele representar con la letra Z. Es
característico de cada elemento químico y representa una propiedad fundamental
del átomo. Este hecho permitió clasificar
a los elementos en la tabla periódica en orden creciente de número atómico.
Molécula:
Configuración electrónica:
K=19=
electrones número atómico 1S 2 2S2
2P6 3P6 4S1
Subniveles:
s, p, d, f orbitales 1.3.7 átomos cuentan electrones 2,6, 10, 14
Silicio
Si= 14=
1S2 2S2
2p6 3S2 3p2
Configuración
electrónica estándar: el único subnivel que queda incompleto es el último.
Ar 18
4S2 configuración electrónica condensada
Ne 10 3D2
3P2
Ni=28= 1S2
2S2 2P6 3S2
3P6 4S2 3D8
Se
busca el gas noble último para realizar la condensada
Ar18 Es2
3D8 configuración electrónica condensada
Bloque
“s” los 2 primeros grupos que empiezan con el hidrogeno terminan en un subnivel
“s “
Del 3
al 12 bloque “d” desde el escandio al cinc
Del 13
al 18 comienza con el boro hasta gases nobles corresponden al grupo “p”
Bloque
separado del lantano al bloque “f”
Metales alcalinos grupo 1 : sodio
potasio los más importantes son los mas
reactivos mucho mas fácil de combinar con los demás elementos.
El único metal que se encuentra en estado liquido es HG
Propiedad
química: facilidad que tiene de combinarse con los otros
Los
elementos del campo 2: metales alcalinotérreos: son ligeramente duros,
conductores de electricidad son menos reactivos que los metales alcalinos los
mas importantes calcio y magnesio.
Del
grupo 3 al 12 elementos de metales de trancsicion buenos conductores de
electricidad son el hierro, cobre, niquel, plata y el oro.
Del 13
al 25 son metales con menor reactividad entre los metales de este grupo el mas
importante son el aluminio y el plomo
Existen
dos grupos especiales lantánidos y actiniodos son llamados elementos de
trancicion interna de gran abundancia en la corteza terrestre en la minería
dentro están los elementos radioactivos uranio, actinio se lo conocen elementos
de periodo porto y útil
Metales
y no metales casi a l final tienen
puntos de fusion (cambian de solido a liquido) densidad baja en los no metales
es muy bajo , carbono, yodo , azufre, bromo en estado liquido.
Los
metales malos conductores de calor o electricidad. Dentro de la clasificacion
de los no metales están :
1
Halogenos: fluor , cloro, bromo, yodo , astato(F, CL ,BR, I, AT)
2
Familia anfígenos: oxigeno, selenio , azufre , telurio(O, SE, S,TE)
En
español se deriva el oxigeno como la propiedad que tiene para formar gases y
acidos
3
Famuilia nitrogenoides: el principal elemento es el hidrogeno. Nitrogeno,
fosforo, arcenico, antimonio(N, P, AS, SB)
4
Familia carbonoides: la carbono , germanio , silicio(C, GE, SI)
El
elemento principal al carbono para la química orgánica
1.
Realizar
la configuracion electronica de los siguientes elementos.
P =15 = 1S2 2S2
2P6 3S2 3P3
bloque “p”
As= 53= 1S2 2S2
2P6 3S2 3P6 4S2
3D10 4P3 bloque “p”
AL= 13= 1S2 2S2
2P6 3S2 3P1
bloque “p”
Au=79= 1S2 2S2 2P6 3S2
3P6 4S2 3D10
4P6 5S2 4D10
5P6 6S2 4F14
5D10 bloque d”
Br=35= 1S2 2S2 2P6 3S2 3P6 4S2 3D10
4P5 bloque “p”
2.
Realizar
la configuracion electronica condensadas de los sigueintes elementos.
Fe=
26=Ar=18= 4S2 3D6 3 al 12 bloque “d”
CL=17=
NE=10= 3S2 3P5 13 al 18 bloque “p”
Ce=58=XE=54=6S2
4F2 bloque f separado del lantano
CD=48=KR=36=5S2
4D10 bloque “d” 3 al 12
SC=21=AR=18=
4S2 3D1 bloque “d” 3 al 12
Enlaces
químicos
Es un
proceso quimico responsable de las interacciones entre atomos, moleculas e
iones que tiene como estabilidad en los compuestos diatónicos y poliatomicos.
Enlaces
químicos metálicos
Es la
unión o conjunto enlace entre un atomo y un numero de valencia.
Los
atomos se agrupan de forma muy orbital unos a otros, lo que produce estructuras
compactas.
Enlace
metalico el acercamiento de 2 atomos cuando se van uniéndose van separando los
electrones se ponen alrededor de los 2 atomos como nubes.
Enlaces
covalentes
Se
define como unión del electrones del ultimo nivel
Características:
1.
Se
presenta solido liquido y gasesoso
2.
Malos
conductores de electricidad
3.
Son
solubles o solventes
4.
Insolubles
o insolventes polares
H2O
tiene una molecula de aga y 2 de hidrogeno
Enlace
quimico ionico
Unión
de atomos:
1
frecuentemente electropositivo
1
frcuente electronegativo
1 de
los atomos capta elctrones del otro
Li
+ f= li f
1S2 2S1
1S2 2S2 2P5 1S2 1S2 2S2
P6
ANION
FLUORURO
Para
leerlo se necesita configuracion electronica
Clasificación:
Iones:
ation (carga electrónica positiva generalmente no metales) y anion (carga eléctrica negativa ation tien
debiendo electrones)
(CLO)-1
y valencias negativas hipo clofito
(CLO)-2
clorito
(CLO)-3
clorato
(CLO)-4
iperclorato
Enlaces
por puente de hidrogeno
El
hidrogeno hace la unión
H2O
2 atomos de hidrogeno y 1 atomo de agua
Metales
valencia fija:
monovalentes trabajan con 1 sola valencia +1
monovalentes trabajan con 1 sola valencia +1
NH4
el hidrogeno no va aquí porque es formador de compuesto
NA, K,
RB, CS, FR, LI, AQ
No
metales = valencia negativas -1
Metales=
valencias postivas +1
Permite
la formulación de composiciones lo elementos necesitan del hidrogeno
Divalentes
+2
BE,CA,RA,
SR, BA, CD, MG, ZN
Trivalentes
+3
AL, GA,
GD,SC, Y
Boro y
bismuto son metaloides
Tetravalentes
+4
Cilicio
y carbono son no metales
Hablar
de no metales no se habla de grupo sino de familia el oxigeno -2 y en excepción
-1 este elemento es formulario de compuestos
Familia
3 se pueden formar con las valencias de la familia 1 para estudio
1
compuesto es la unión de elementos
1
caracteristica que tienen los compuestos es la formula
H2O
molecula de agua 2 atomos de hidrogeno y 1 de oxigeno
Al
momento de intercambiar que estan a la parte superior se ponen en la parte
inferior y no se toma en cuenta los signos.
Existen
diferentes tipos de compuestos:
Binario
2 elementos
Terciario
3 elementos
Cuaternarios
4 elementos especialmente las sales
Compuestos cada elemento se llama reactivo y lo que se
obtiene producto
1
reactivo + otro reactivo serian binarios
Metales de valencia fija
Monovalentes +1 Divalentes +2 Trivalentes +3 Tetravalentes +4
NA BE AL OS
K CA GA IR
RB RA GD
CS SR SC
FR BA Y
LI CD IN
AQ MG
NH4 ZN
Pentavalantes +5
Hexavalentes+6
TA W
U
MO
METALES DE
VALENCIA VARIABLE
1-2 1-3
2-3 2-4 3-5 2-3-6 2-3-4-6-7
CU AU FE PB V CR MN
HG TL CO PT
PD
NO METALES
FAMILIA 1 FAMILIA 2 FAMILIA 3 FAMILIA 4
HALOGENOS ANFIGENOS NITROGENOIDES CARBONOIDES
(1,3,5,7) (2,4,6) (1, 3, 5, 7) (4)
BR, I, CL, F(1) SE, S, TE, O (-2) N, P, AS, SB C (2,4), SI, GE
Reglas de formulación:
Oxigeno siempre trabaja con valencia -2 a excepción de los peróxidos valencias -1
Siempre que se puede se simplifica a excepción de los peróxidos
Cuando escribimos los elementos para formular con la valencia
Primero están los positivos
Nomenclatura
existen 3 tipos de nomenclatura
N. Tradicional Oxido básico: se usa oxido
Hidracidos : hidracidos
Hidruros: hidruro
N. tradicional : palabra grupo funcional
N. stock (I) (II) (III)
N. sistematica: mono, di, tri, tetra, penta, hexa, hepta
A los variables se usa oso e ico oso a los menores ico a los mayores
Compuestos binarios
Oxidos:
son compuestos binarios formados por la combinacion de un elemento y el oxigeno. Hay 2 clases de oxidos basicos y oxidos acidos (anhidridos)
Oxido básico
son compuestos binarios formados por la combinacion de un metal y el oxigeno
Compuestos binarios metal + oxigeno
oxido de estroncio NT
oxido de estroncio (II) N. STOCK
Monoxido de estroncio N.S.
Oxido férrico N.T
Oxido de hierro (III) N. STOCK
Trióxido de dihierro N.S
Oxido de wolframio
Oxido de walframio (VI)
Trióxido de wolframio
Oxido acidos o anhidridos
BR 1+ O-2 = BR2O anhídrido hipobromoso/ oxido de dibromo
BR 3+ O-2 =BR2O3 anhidrido bromoso / trióxido de dibromo
BR 5+ O-2=BR2O5 anhidrido brómico / pentaoxido de dibromo
BR 7+ O-2=BR2O7 anhidrido perbromico / heptaoxido de dibromo
Peroxidos
lo podemos considerar como oxidos mas oxigeno del que corresponde por la valencia de este elemento
nunca se simplifican
Ba2
+ O-2 = BaO + O-1 = BaO2 dióxido de bario / peróxido
de bario
MgO2=
peróxido de mercurio/ dióxido de magnesio
compuestos binarios hidrogenados
Hidruros
metales mas el hidrogeno siempre tendra valencia 1
Mg2
+ H-1 = MgH2 hidruro
de magnesio / hidruro de magnesio (II)/
dihidruro de magnesio
Cr6
+ H-1 = CrH6
hidruro cobaltoso / hexahidruro de cromo
GaH3
hidruro de galio (III)
Hidracidos
no metales trabajan solo con la valencia de la familia
H+1
+ Br-1 = HBr bromuro d ehidrogeno / acido brómico
H+1
+ S-2 = H2S Se seleniuro de dihidrogeno / acido
selenhidrico
Compuestos
especiales
NH3 amoniaco / trihidruro de nitrogeno
BH3 borano
AsH3
arsina
SbH3
estibina
PH3
fosfina
GrH4
germano
SiH4
silano / tetahidruro de silano
CH4
metano
Sal binaria
Metal +
no metal
El no
metal valencia fija de la familia
Na+1
+ Cl-1 = Na Cl cloruro de sodio
Fe+3
+ S-2 = Fe2 S3 sulfuro férrico
TlBr bromuro talioso
Utilizan
la terminacion uro en metals se usa oso – ico
Compuestos
ternarios
Hidroxidos
Son compuestos
formados por un metal y el grupo hidroxilo (OH). Su formula general es M(OH)x
El OH
tendra valencia -1.
Al3
+ (OH)-1 = Al (OH)3 hidroxido de aluminio/ hidróxido de aluminio
III
Trihidroxido de aluminio
TL1+
(OH)-1 = Tl(OH) hidroxiido talioso/ hidróxido de talio I
Monohidroxido de talio
Zn2
+ (OH)-1 = Zn (OH)2 hidroxido de zinc/ hidróxido de zinc
II
Dihidroxido de zinc
Oxaxidos
son compuestos ternario formados por no metal, oxigeno e hidrogeno. Se obtiene a partir del oxido acido o anhidrido correspondiente sumandole una molecula de agua.
familia 1( 1 molecula de agua)
111 hipo.....oso
112 oso
113 ico
114 per.....ico
familia2 (1 molescula de agua)
212 hipo....oso
213 oso
214 ico
familia 3
112 meta.... oso
113 meta..... ico
425 piro....oso
427 piro....ico
313 orto.....oso
314 orto.....ico
meta ( 1 molecula de agua)
piro (2 moleculas de agua)
orto(3 moleculas de agua)
familia4
213 meta....ico
414 orto....ico
P2O3
+ H2O = HPO2 acido metafosforoso
P2O5
+ 2H2O = H4P2O7 acido pirofosfórico
P2O3
+ 3H2O = H6P2O6 = H3PO3
acido ortofosforico
Si no
se pueden simplificar los 3 no se simplifican
Sales ternarias:
Es la combinacion de un oxaxido y un hidroxido cambiamos el "oso" por "ito" y el "ico" por "ato".
HBrO + Al (OH) 3 = Al (BrO)3 + H2O
acido hipobromoso hidroxido de aluminio hipobromito de aluminio
H2(SO4) + Mg (OH)2 = Mg(So4) + H2O
acido clorico hidroxido ferrico clorato ferrico
H4P2O7 + Os(OH)4 = Os(P2O7)+H2O
acido forsforico hidroxido de osmio pirofosfato de osmio
LOS CUARTENARIOS
Compuestos formados por 4 elementos
·
Sales
oxidales acidas:
·
Sales
oxidales básicas
·
Sales
oxidales mixtas
·
Sales
oxidales dobles
Son
aquellos compuestos que además del catión
y del anión, llevan iones óxidos o
iones hidroxilo. Se nombran de manera similar a otros tipos de sales, cuidando
de intercalar la palabra óxido, según corresponda, precedida del prefijo
numérico cuando sea necesario. Si partes del ácido sulfúrico (H2SO4) y sólo
sustituyes uno de los hidrógenos por un catión metálico, obtienes una sal
cuaternaria: KHSO4 ó NaHSO4.
·
Nomenclatura
·
Sales Cuaternarias: Estas sales se forman
por cuatro elementos un metal, un no metal un ion hidroxilo y oxígeno.
Fórmula
·
Co(OH)NO3 Hidroxi nitrato de Cobalto(
)Hidróxido Nitrato de Cobalto .
·
Bi(OH)2NO3 Nitrato Dihidróxido de
Bismuto( )Dihidroxi nitrato de Bismuto.
·
VOSO4 Sulfato Óxido de Vanadio (IV)o Oxi
Sulfato de Vanadio(IV)
·
Pt(OH)NO3 Nitrato Hidróxido de Platino
(II)Hidroxi nitrato de Platino(II)
Deberes
EJERCICIO 1
EJERCICIO 1
1.- PERÓXIDO DE MERCURIO (II): ___________Hg2O2_________________
2.- PERÓXIDO DE ORO (I): ______________Au O2_________________________
3.- DIÓXIDO DE ESTRONCIO: _________Sr2 O2________________________
4.- DIÓXIDO DE DILITIO:______________Li O2___________________
5.- PERÓXIDO DE RADIO: __________Rd O2________________________
EJERCICIO 2 COMPLETA LA TABLA
FORMULA
|
N.SISTEMATICA
|
N.STOCK
|
N. TRADICIONAL
|
AuH3
|
Tetrahidruro de oro
|
Hidruro de oro III
|
Hidruro de oro
|
LiH
|
Hidruro de litio
|
Hidruro de litio I
|
Hidruro litioso
|
PbH2
|
Dihidruro de plomo
|
Hidruro de plomo II
|
Hidruro plomoso
|
AgH
|
Hidruro de plata
|
Hidruro de plata
|
Hidruro platonoso
|
Pb3
|
Trihidruro de fosforo
|
Hidruro de fosforo II
|
Fosfina
|
CH4
|
Tetrahidruro de carbono
|
Hidruro de carbono IV
|
Metano
|
AsH3
|
Trihidruro de arsenico
|
Hidruro de azufre
|
Hidruro arsénico
|
EJERCICIO 3
Identifique de que tipo son los siguientes
Óxidos
y nómbrelos:
NO2 = ANHIDRIDO y se nombra DIOXIDO DE NITROGENO
Cl2O7 = ANHIDRIDO y se nombra
HEPTAOXIDO DE DICLORO
I2O5 = ANHIDRIDO y se nombra PENTAOXIDO DE DIYODO
SO = OXIDO BASICO y se nombra OXIDO DE AZUFRE
TeO2 = OXIDO BASICO y se nombra DIOXIDO DE TELURIO